Железосерные кластеры (Fe-S-кластеры) – структурированные комплексы атомов железа и серы, обладающие высоким окислительно-восстановительным (редокс) потенциалом и являющиеся кофакторами большого количества клеточных ферментов, участвующих в редокс-реакциях. Биосинтез Fe-S-кластеров в клетках человека происходит в митохондриях – органеллах, отвечающих за энергетический обмен клетки. Нарушения процесса биосинтеза Fe-S-кластеров вследствие мутаций в генах ферментов, катализирующих соответствующие реакции, являются причиной тяжелых наследственных заболеваний человека, самым частым из которых является атаксия Фридрейха: этим заболеванием страдает примерно каждый 10-тысячный человек на нашей планете. Атаксия Фридрейха вызывается мутациями в гене фратаксина, центрального фермента биосинтеза Fe-S-кластеров.
Чтобы выявить последствия мутаций в гене фратаксина на клеточном уровне, которые ранее не были известны, исследователи провели широкомасштабный скрининг белков человека, количество которых меняется в ответ на удаление из генома гена фратаксина. Таких белков оказалось достаточно много, и практически все они относились к белкам, содержащим Fe-S-кластеры. Однако белком, количество которого снижалось максимально, оказался METTL17 – митохондриальный белок, считающийся фактором сборки митохондриальных рибосом, для которого ранее не было известно никакой связи с Fe-S-кластерами.
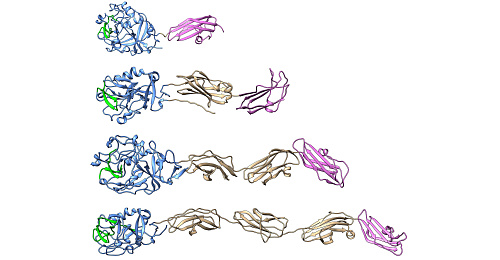
Биофизическими методами удалось показать, что белок METTL17 в норме содержит в своем составе Fe-S-кластер, который стабилизирует связывание белка с митохондриальной рибосомой. Данные о стабилизации были получены методом криоэлектронной микроскопии: было собрано несколько миллионов микроскопических изображений комплекса белка METTL17 с митохондриальной рибосомой, которые затем были наложены друг на друга и обработаны с использованием высокопроизводительных вычислений. Это позволило исследователям получить изображение комплекса с разрешением 2,3 ангстрема и «разглядеть» в комплексе мельчайшие детали вплоть до положения отдельных атомов.
Затем в работе было показано, что в ответ на удаление из генома гена METTL17 происходило уменьшение количества митохондриальных рибосом и эффективности биосинтеза белка в митохондриях, за который как раз и отвечают митохондриальные рибосомы. Более того, в точности такой же эффект наблюдался и при внесении в ген METTL17 мутаций, приводящих к удалению из белка отдельных аминокислот, критически важных для связывания Fe-S-кластера. Мутантные версии белка METTL17, помимо этого, не могли взаимодействовать с митохондриальной рибосомой.
«Наши данные свидетельствуют о том, что белок METTL17 функционален только при наличии в нем железосерного кластера, - говорит один из авторов работы, Петр Каменский, доктор биологических наук, профессор биологического факультета МГУ. – Только в таком состоянии он связывается с митохондриальной рибосомой и обеспечивает нормальное прохождение митохондриальной трансляции. При этом в ходе этого процесса синтезируются в основном белки-компоненты дыхательной цепи митохондрий, которая богата Fe-S-кластерами. Таким образом, наши результаты показывают наличие в митохондриях «железосерного контроля качества»: нормальный биосинтез митохондриальных белков, для функционирования которых необходимы Fe-S кластеры, будет идти только в том случае, если уровень самих Fe-S кластеров в митохондриях является достаточно высоким. Если же Fe-S кластеров недостаточно, они будут отсутствовать в составе METTL17, и митохондриальная трансляция будет ингибирована; при этом этот процесс в данной ситуации был бы бессмысленным, поскольку продукты митохондриальной трансляции все равно не способны нормально работать без железосерных кластеров. Эти результаты могут в будущем помочь в разработке эффективных способов лечения атаксии Фридрейха и других болезней человека, вызываемых нарушениями метаболизма железосерных кластеров».